Trouvé en parcourant les archives de ScienceRoll, cet outil permet de calculer la probabilité de couleur des yeux d’un enfant en fonction de celles de ses parents et grand-parents.

Archives de catégorie : Ophtalmologie
Les origines d’une cataracte révélées par la microscopie à force atomique
Communiqu̩ Institut Curie/Inserm/CNRS Р11 octobre 2007 :
Des chercheurs ont pour la première fois observé à très haute résolution un tissu pathologique grâce à la microscopie à force atomique, une technique permettant d’obtenir une image de la surface d’un échantillon avec une précision d’un milliardième de mètre. Ils ont étudié la membrane des cellules d’un cristallin chez un patient atteint de cataracte ce qui leur a permis d’identifier les modifications biologiques responsables de cette pathologie chez ce malade. Ces résultats, publiés dans le Journal of Molecular Biology, sont les premiers à montrer que l’observation à haute résolution d’un tissu pathologique permet de livrer des informations sur l’origine moléculaire d’une maladie. La microscopie à force atomique devient ainsi une technique de nano-imagerie médicale.
Vous pouvez lire le communiqué de presse en entier sur le site de l’INSERM… et l’abstract sur la page « Publications » de ce site : bel exemple de coopération entre chercheurs (l’équipe de Simon.Scheuring) et un ophtalmologiste du CHNO des Quinze-Vingts, à l’image de ce qui devrait se développer une fois l’Institut de la Vision inauguré (début 2008).
ETDRS en pratique
Voilà la dernière version du cours pour les orthoptistes des Quinze-Vingts devant réaliser les mesures d’acuité visuelle ETDRS :
Ces fichiers sont à votre disposition pour une utilisation personnelle (consultation) :
aucun élément ne peut être diffusé sans mon autorisation.
N’hésitez pas à me contacter pour toutes questions.
AFSSAPS et injection intra-vitréenne de Kenacort
Après la FDA aux USA en février dernier, c’était au tour de l’AFSSAPS dans le courant de l’été de nous diffuser un courrier d’alerte concernant les risques de l’utilisation du Kenacort en intra-vitréen, et rappelant que cette utilisation, n’ayant fait l’objet d’aucune étude, est « hors AMM » :
Le laboratoire Bristol-Myers Squibb (BMS), en accord avec l’Agence Française de Sécurité Sanitaire des Produits de Santé (Afssaps) souhaite vous communiquer d’importantes données de pharmacovigilance concernant les spécialités KENACORT RETARD 40 mg/1ml et 80mg/2ml (suspensions injectables d’acétonide de triamcinolone):
Des cas graves d’endophtalmie, d’inflammation oculaire, d’augmentation de la pression intraoculaire et de troubles visuels incluant des cas de cécité, ont été rapportés à la suite d’administrations intravitréennes de KENACORT RETARD au cours d’utilisations hors-AMM. La plupart de ces cas ont nécessité une prise en charge thérapeutique ou chirurgicale.
A ce jour, aucune étude menée par BMS n’a évalué la tolérance de l’administration de KENACORT RETARD par injection sous-conjonctivale, sous-ténonienne, rétrobulbaire ou intraoculaire (voie intravitréenne).
Ces constatations sont elles suffisantes pour avoir peur de continuer à utiliser le Kenacort ? Probablement non.
- Si BMS n’a effectivement fait aucune étude concernant le Kenacort utilisé en intra-vitréen, les publications sur le sujet ne manquent pas, surtout depuis 2003 :
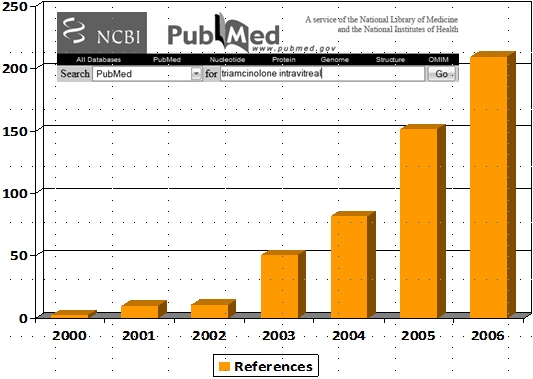
- Les effets secondaires rapportés n’ont finalement pas grand chose d’inquiétant :
- une endophtalmie peut survenir à la suite de toute injection intravitréenne : leur existence n’a pas empêché la mise sur le marché des anti-VEGF en traitement de la DMLA (avec des taux dans certaines études parfois plus importants que ceux actuellement rapportés). De même, ce risque ne nous empêche pas d’opérer des cataractes (chez des patients avec parfois des niveaux de vision préopératoires bien supérieurs à ceux à qui nous proposons le Kenacort…);
- Une hypertonie peut survenir après tout traitement corticoïde, quelle qu’en soit la modalité d’administration (on parle de près de 30% de « répondeurs » après traitement par collyres corticoïdes, et cela ne nous empêche pas de les utiliser largement).
Si l’un des corticoïdes actuellement en développement pour un usage spécifique en ophtalmologie (j’en reparle bientôt) arrive sur le marché, ce sera probablement avec le même type d’effets secondaires…
A mon avis, cette lettre nous rappelle donc juste notre devoir : bien évaluer le rapport bénéfice-risque avant de poser une indication, raisonnée (ce qui est finalement relativement facile en l’absence d’alternative !) et en informer nos patients (comme avant toute procédure).
Par contre, plus que les complications sus-citées, c’est peut-être une éventuelle toxicité du Kenacort (pour le moment encore controversée : des études animales rapportent régulièrement l’existence de phénomènes toxiques des conservateurs et/ou de la triamcinolone elle-même, tandis qu’à ma connaissance, aucune série clinique n’est venue confirmer ces données) qui pourrait nous faire changer d’attitude.
Quoi qu’il en soit, vivement qu’arrivent les premiers résultats des grandes études randomisées actuellement menées aux USA sous l’égide du National Eye Institute (en traitement de l‘oedème maculaire diabétique et des occlusions veineuses)… avec la réserve que le produit utilisé est une triamcinolone spécialement fabriquée par Allergan, justement sans conservateur…
Où en est le développement de Retaane ?
Alcon a publié il y a quelques jours un communiqué de presse (Source : OSN SuperSite), suite à un courrier de la FDA réclamant des données complémentaires pour approuver Retaane (acétate d’anécortave) en traitement de la DMLA exsudative :
HUENENBERG, Switzerland — Alcon has received an approvable letter from the U.S. Food and Drug Administration for Retaane, its anecortave acetate treatment for wet age-related macular degeneration. However, the FDA will require an additional clinical trial before it grants final approval, according to an Alcon press release.
Alcon has no immediate plans to conduct a new study due to the difficulty of recruiting patients in light of other treatments currently available for wet AMD, the release said.
Plus que la difficulté de recrutement, je me demande si le frein principal à poursuivre le développement n’est pas plutôt le fait qu’il n’ait malheureusement pas été possible de démontrer (statistiquement) la non-infériorité de Retaane par rapport à la photothérapie dynamique avec Visudyne (Slakter JS & al. Anecortave acetate (15 milligrams) versus photodynamic therapy for treatment of subfoveal neovascularization in age-related macular degeneration. Ophthalmology. 2006 Jan;113(1):3-13) : difficile dans ces conditions de concurrencer maintenant les anti-VEGF !
Par contre, il aurait peut-être été intéressant de le tester en relai des traitements anti-VEGF ?
However, the company continues to believe that Retaane (15 mg anecortave acetate suspension) could play a role in the treatment of wet AMD. Alcon plans to continue supporting the Anecortave Acetate Risk-Reduction Trial, which is studying the ability of Retaane to reduce the risk of the progression from the dry form of AMD to the wet form. This trial, which is fully enrolled with more than 2,500 patients, is expected to be completed within 3 years, according to the release.
In addition, Alcon is conducting clinical studies of anecortave acetate, the active ingredient in Retaane, for the treatment of glaucoma.
Effectivement, deux études sont en cours pour essayer de convertir ce traitement de la DMLA en anti-glaucomateux :
- Anecortave Acetate for Treatment of Steroid Induced Intraocular Pressure (IOP) Elevation
- Safety and Efficacy of Anecortave Acetate in Patients With Open-Angle Glaucoma
Retaane suspension remains commercially available in several countries outside of the United States.
Voilà ce que cela donne en Suisse d’après une publication récente… (Hayek S & al. First clinical experience with anecortave acetate (Retaane). Klin Monatsbl Augenheilkd. 2007 Apr;224(4):279-81) :
BACKGROUND: Anecortave acetate is an angiostatic cortisene which is injected as a posterior juxtascleral depot and has been shown to be effective in the treatment of exudative age-related macular degeneration (AMD). The compound is not yet approved in Switzerland but can be used as « compassionate use » in individual cases.
PATIENTS AND METHODS: An uncontrolled case series with standardised documentation of ETDRS visual acuity, near acuity, need for magnification and fluorescein angiography was performed.
RESULTS: 22 eyes of 19 patients (8 male, 11 female, average age 78.8 years) were treated with a posterior juxtascleral depot injection (PJD) of 15 mg anecortave acetate. The mean change in visual acuity after 3 months in eyes treated with anecortave acetate was -2.6 ETDRS letters corresponding to 0.52 Snellen lines. 3/20 eyes gained more than 1 line. 11/20 eyes showed stable visual acuity (+/- 1 Snellen line, +/- 5 ETDRS letters). 5/20 eyes developed moderate vision loss (one to two Snellen lines, 6-10 ETDRS letters). 1/20 lost 18 ETDRS letters (> 3 Snellen lines). There were no moderate or severe adverse events.
CONCLUSIONS: A PJD of 15 mg anecortave acetate is safe and well tolerated. In eyes with occult CNV without recent progression or with residual neovascular activity after photodynamic therapy anecortave acetate may be an alternative therapeutic option before considering intravitreal anti-VEGF agents due to the much less invasive character and lower risk profile.
On semble effectivement bien loin des résultats des anti-VEGF…
